一、
无托槽矫正器介绍
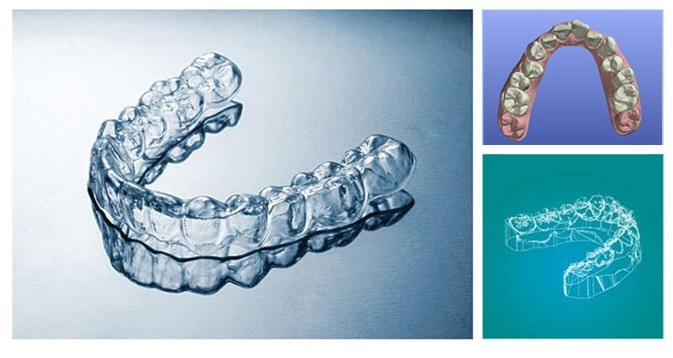
无托槽矫正器,是由高分子纳米材料制成的。这种材料外观透明,类似塑料,但实则是经过精心挑选与特殊处理的。它不仅具有极高的透明度,使得牙套在佩戴时几乎不可见,还具备较适合牙齿移动的弹性和刚性。每戴上一个新的牙套,它就会以微小的力量挤压牙齿,使其朝向预设的目标位置移动。通过不断更换新的牙套,牙齿逐渐达到理想的排列状态。
二、个性化设计与3D打印技术
无托槽矫正器的另一个重要特点是其个性化设计。在正畸治疗前,牙医会利用的口腔扫描技术获取患者的牙齿三维模型,并通过计算机软件进行模拟分析。根据患者的牙齿排列情况、面部特征以及个人需求,医生会设计出一系列个性化的矫正方案。这些方案随后会被转化为具体的牙套制作指令,利用3D打印技术有效制作出来。每一副牙套都是少有的,专为患者量身定制,确保了矫正效果的有效性和高 效性。
三、附件与支抗设计
虽然无托槽矫正器没有传统牙套中的金属托槽和弓丝,但它通过一种称为“附件”的小凸起来辅助牙齿的移动和牙套的固定。这些附件是由正畸医生选择与患者牙齿颜色相近的光固化树脂制成的,通过粘结在牙齿上,为牙套提供了稳定的着力点。它们就像是小小的榫钉,将牙套与牙齿紧密连接在一起,确保矫治力的有效传递。
此外,无托槽矫正器还注重支抗设计。在牙齿移动过程中,任何施于治疗牙齿的力都会产生一个相反的反作用力。为了支持这种移动并防止不必要的牙齿移动,隐形牙套在设计时会考虑到支抗因素。通过合理的支抗设计,可以确保牙齿按照预定的轨迹移动,达到较佳的矫正效果。
四、定期更换与持续监控
无托槽矫正器需要定期更换以保持矫治力的持续性和有效性。一般来说,患者需要每10天至两周更换一副新的牙套,并严格按照医生的指导进行佩戴。每副牙套都会根据患者的牙齿移动情况进行微调,以确保整个矫正过程的顺利进行。同时,医生还会定期对患者进行复查和调整,以监控矫正效果并及时解决可能出现的问题。
无托槽矫正器以其独特的材料特性、个性化的设计以及高 效的矫正效果,成为了现代牙齿正畸技术的重要组成部分。它不仅能够实现牙齿的美观排列,还具有极高的舒适度和便捷性。通过不断的技术创新和应用实践,隐形牙套正引领着牙齿正畸领域的新纪元。未来,随着科技的不断进步和人们对口腔健康关注度的提高,无托槽矫正器有望为更多患者带来福音。
五、无托槽矫正器的产品注册申请要点
1.申请表
1.1产品名称
产品名称应与产品特征一致,由一个核心词和一般不超过三个特征词组成。命名举例有:无托槽矫治器、无托槽透明矫治器、无托槽压膜矫治器、无托槽正畸矫治器。产品名称不建议含有“隐形”等虚无、假设的概念性名称或者其他具有误导性、欺骗性的内容。
1.2注册单元划分的原则和实例
注册单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
例如:无托槽矫治器用原材料不同的产品,建议划分为不同的注册单元。
2.产品列表
以表格形式列出拟申报产品的型号规格、结构及组成、附件,以及每个规格型号的标识(如条形码、目录、型号或部件号码,器械唯一标识等)和名称/描述的说明(如尺寸、材质等)。
3.既往沟通记录(如适用)
在产品申报前,如果注册申请人与监管机构针对申报产品以会议形式进行了沟通,或者申报产品与既往注册申报相关,应当提供申报前与监管机构的联系情况和沟通记录;如不适用,应当明确声明申报产品没有既往申报和/或申报前沟通。
4.主文档授权信(如适用)
注册申请人应当对主文档引用的情况进行说明。
5.其它管理信息
5.1按照特殊、应急等特殊注册程序进行申报的,注册申请人应提交通过创新医疗器械审查或医疗器械应急审批的相关说明。
5.2委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议。
六、综述资料
1.产品的结构和组成及其他相关(功能)描述
产品由适用于矫治的热塑性高分子材料制成。
1.1原材料情况
对于使用已注册的牙科正畸矫治器用膜片材料生产的无托槽正畸矫治器,需提供注册证信息,厚度及型号等。对于使用未注册的牙科正畸矫治器用膜片材料生产的产品,需参照YY/T 1819《牙科学 正畸矫治器用膜片》完善相应性能研究,并在技术要求附录部分补充相应性能指标。
1.2临床设计情况
申请人应描述参与的临床设计情况,可以流程图的形式提供。至少应包含以下内容:
临床机构需要提供的资料、数据 :如患者口内、面部照片、全颌曲面体层片、头颅侧位定位片、口腔软硬组织表面的三维形貌及纹理(口内扫描)数据、临床矫治方案等电子资料,硅橡胶印模、咬合记录等实物资料。如三维数字牙颌模型由申请人对硅橡胶印模扫描获得,应予以明确。
设计软件信息:提供设计界面截图(如牙颌模型的三维数字化重建、牙颌模型的三维数字化诊断分析、牙齿的切分、虚拟牙龈的生成、附件的设计与粘结、邻面去釉、牙齿的移动、治疗效果的三维动态演示与修改等等)。还应明确软件发布版本、外购或自行研发情况。
1.3医工交互情况
申请人应至少描述数据库及数据库的维护管理情况、数据交互平台和数据传输格式及在该过程中保证数据的安全性、可重复性(所有数据应当在该平台随时查验)、正确性和完整性等的控制情况,应确保数据的可追溯性,如涉及国家保密要求的需获得相关部门保密认证。通过约定的交互平台向临床医生展示设计方案并有临床医生确认情况及对临床医生确认后的资料做内部审查验证及向临床医生回复确认情况,设计开发人员、生产管理人员能力描述(如专业背景、岗位相关专业技能培训)。
2.产品工作原理/作用机理
无托槽矫治器在使用状态下包覆患者牙齿的牙冠部分,借助于矫治器与牙颌上相应牙齿位置的差别形成的回弹力,采取持续的外力并在支抗的作用下调整牙齿位置使其恢复正确咬合关系。
3.型号规格
对于存在多种型号规格的产品,应当明确各型号规格的区别。应当采用对比表及带有说明性文字的图片、图表,描述各种型号规格的结构组成、功能、产品特征和性能指标等内容。
4.包装描述
以图片和文字相结合的方式明示申报产品的包装信息,以列表形式说明所有包装内容物。提供包装材料的性质,评价包装材料对产品储存过程的影响。标明最小销售单元的包装数量。
5.研发历程
应阐述申请注册产品的研发背景和目的。如有参考的同类产品或前代产品,应当提供同类产品或前代产品(如有)的信息,并说明选择其作为研发参考的原因。应列表比较说明申报产品与同类产品和/或前代产品在工作原理、结构组成、制造材料、性能指标,以及适用范围等方面的异同。
6.适用范围和禁忌证
6.1适用范围:无托槽矫治器适用于正畸治疗。通常单个矫治器使用时间为2周左右,整套矫治器使用时间为1~2年。
适用范围的表述应客观、清晰,使用有明确定义或行业公认的术语或名词。
6.2禁忌证:应包括该产品不适用的疾病、情况及特定的人群。如:进行性牙周炎患者禁用等。
7.不良事件情况(如适用)
应当提交申报产品的上市、销售、不良事件和召回等相关情况分析资料。
医疗器械注册证找
河南华睿医疗,15年申报经验,专业、负责,一次性让您顺利下证。
医疗器械注册证是医疗器械产品进入市场的法律凭证,其作用如下:1、确认医疗器械产品合法性;2、确认医疗器械产品安全有效;3、规范医疗器械市场秩序;4、保护患者使用医疗器械的安全有效。医疗器械注册证包括《医疗器械注册证》、《医疗器械经营许可证》和《医疗器械生产许可证》等。
河南华睿医疗专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。