网站导航
13673698348

来自: 发布时间:2022-11-23 浏览 :2003次
| 阶段 | 内容及要求 | 对象 | 学时 |
|---|---|---|---|
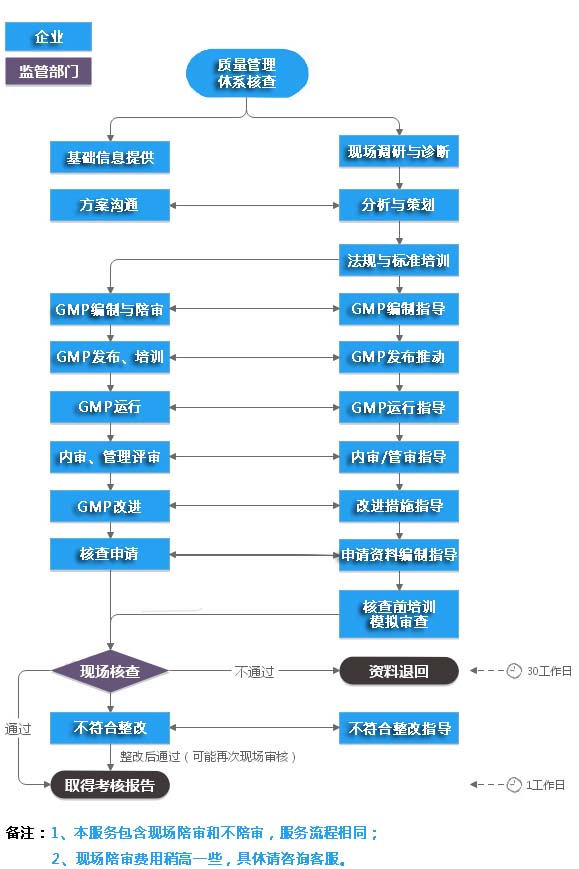
| 项目启动阶段 | 主要进行实施GMP的动员性培训 1、实施GMP的目的、意义、紧迫性;政策法规;国内外实施GMP概况;该企业实施GMP的有利因素和不利因素分析等。 2、关于GMP和GMP基本内容 |
全员 | - |
| 项目实施初期 | 1、硬件施工与验收培训:以洁净厂房施工验收规范和GMP要求为依据进行施工管理,技术规范要求和注意事项等内容的培训。 2、文件编制培训(一):文件编制的目的、意义、要求、分类,存在问题和文件系统、文件目录等。 3、文件编制培训(二):技术标准类文件编制。以工艺规程为重点,同时讲解质量标准和检验规程的编制。 4、文件编制培训(三):工作标准的编制,以生产操作SOP为重点,同时讲解设备SOP,清洁SOP编制。 5、自查培训:GMP认证检查评定标准培训:以认证评定标准225条为依据,针对企业相关条款,逐条讲解,使企业人员明白各条款及其涵盖内容应如何贯彻实施;如何应对检查。并能多次按条款进行自查整改。 |
施工方人员; 监理人员; 建设方人员; 企业领导; 文件编制人员 |
- |
| 项目实施中期 | 文件编制培训(四):验证文件的编制 1、讲解验证的定义、类别、验证步骤、必须的验证对象、具备验证的条件; 2、讲解各类验证方案的编制:净化空调系统、水系统、设备、工艺、清洁; 3、验证报告的形成及验证文件归档。 |
文件编制人员; 验证小组人员 |
- |
| 项目实施中后期 | GMP认证检查评定标准培训:以认证评定标准为依据,针对企业相关条款,逐条讲解,使企业人员明白各条款及其涵盖内容应如何贯彻实施; 如何应对检查。并能多次按条款进行自查整改。 |
企业领导和各级管理人员或全员 | - |
| 文件名称 | 文号 | 发布时间 | 实施时间 |
|---|---|---|---|
| 《医疗器械生产监督管理办法》 | 药监总局令7号 | 2014年7月30日 | 2014年10月1日 |
| 《医疗器械生产质量管理规范》 | 药监总局公告64号 | 2014年12月29日 | 2015年3月1日 |
| 其他标准 | 文号 | 发布时间 | 实施时间 |
| 《GMP现场核查实施记录》 | - | - | - |
| 《无菌医疗器具生产管理规范》 | YY 0033-2000 | - | - |
| 阶段 | 时限 |
|---|---|
| 现场调查、问题整合阶段 | 大约7天 |
| 辅导时间 | 大约6个月 |
| 核查时间 | 大约1天 |
| 首次GMP建立和核查辅导 | GMP体系年度辅导(原有基础上做) |
| 编写质量管理体系文件(通用文件) | 内部审核并提出整改建议(2次) |
| 指导客户编写技术文件(产品专用文件) | 指导开展管理评审(2次) |
| 指导客户准备GMP认证所需资料 | GMP相关法规知识培训 |
| 指导客户进行厂房区域规划 | 指导修改体系文件 |
| GMP相关法规知识培训 | 提供部分文件及记录模板 |
| 解答客户的疑问,协助客户解决运行GMP时遇到的问题 | 日常质量管理体系相关问题解答 |

未办理成功可全额退款
明码标价无任何隐性消费
签订合同,开具正规发票
一个项目配多名服务人员
客服二十四小时全天在线